接种HPV疫苗,你是否还在担心安全性和有效性......
- 手机资讯
- 2024-12-01
- 37
2022年一项关于医护专业实习生对HPV疫苗相关认知的调查研究显示,疫苗有效性、持续时间和安全性在影响接种的主观因素中排前三[1]。相比于乙肝疫苗、卡介苗等,HPV疫苗在中国上市时间可能还比较短,目前仍有许多人乃至部分医护人员对HPV疫苗的认知存在一些异议,这也加剧了提高疫苗接种率的难度。针对这些情况,我们这次“一文全解HPV疫苗疗效和安全性”,一次性get!
“知其然,更要知其所以然”,在讨论疫苗有效性和安全性前,我们先来了解HPV疫苗由哪些成分组成?怎么发挥作用?
①HPV疫苗的主要成分有哪些?
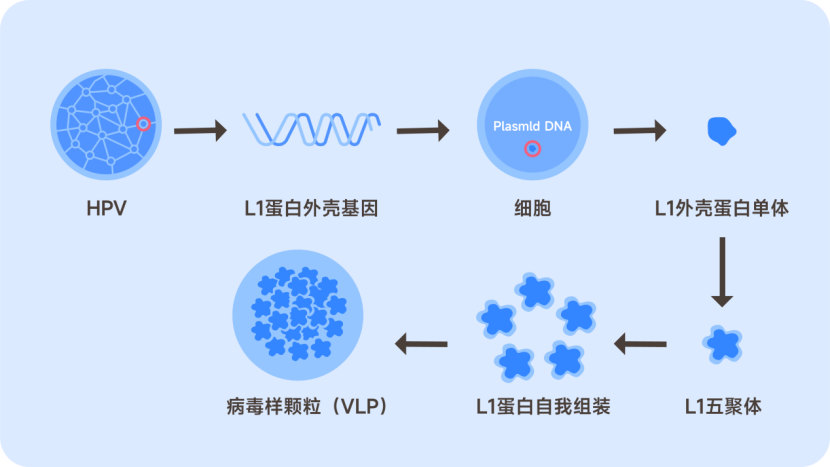
HPV疫苗(中文全称:人瘤病毒疫苗)是一种由人工合成的、根据不同HPV型别的病毒衣壳蛋白L1组装而成的基因工程疫苗。利用基因重组技术制成的外观类似HPV的衣壳蛋白L1并不是真正的HPV,我们称为“病毒样颗粒”,这就是疫苗的有效成分,也就是抗原。
为了加强抗原的作用,在制作工序中还需要添加佐剂。最后这种添加了佐剂的重组蛋白再添加一些其他成分就形成了市场上的重组HPV疫苗。
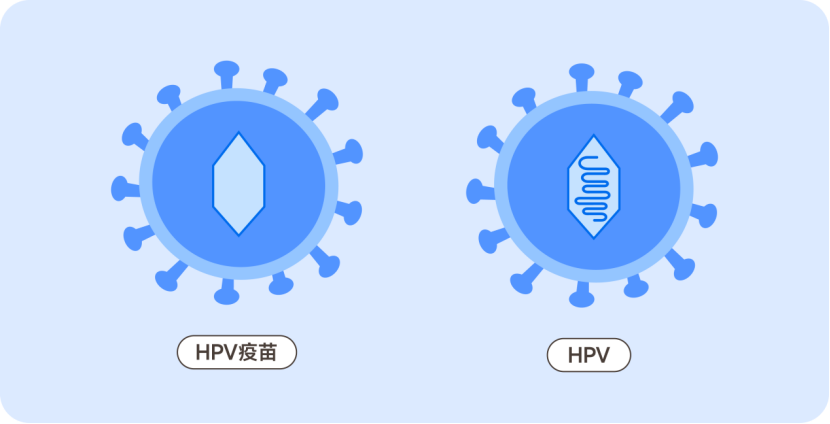
(HPV疫苗和病毒的区别,约苗原创)
②HPV疫苗如何产生作用?
HPV疫苗主要诱导机体体液免疫反应,产生的中和性抗体在HPV进入机体时即可与病毒抗原结合,从而预防HPV感染导致的一系列疾病,如宫颈癌。疫苗产生的抗体可透过血管壁,在局部上皮组织形成较高浓度。当HPV通过黏膜上皮的细微伤口接触基底层细胞时,位于上皮组织中的抗体即可与病毒结合,发挥中和作用[2]。
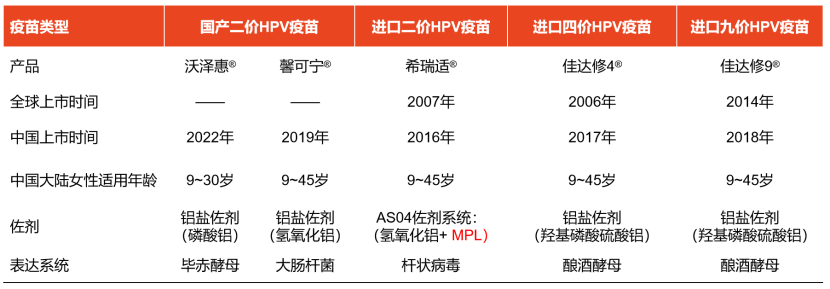
宫颈癌是一种病因明确的癌症,几乎都是由高危型HPV持续感染导致。因此,接种HPV疫苗是预防宫颈癌的有效手段。目前我国已上市了5种HPV疫苗,具体见下表↓
我国已批准上市的HPV疫苗[3-7]
MPL:3-O-去酰基-4’-单磷酰脂 A
☞前面说到佐剂是HPV疫苗的重要组成部分,它是一种能够辅助抗原应答、调节免疫反应的物质。在上市的5种疫苗中主要使用2种佐剂:铝盐佐剂和AS04佐剂。铝盐佐剂是人类最早发现并广泛使用的疫苗佐剂,在1920年就被用于人用疫苗。而AS04佐剂属于创新佐剂,它是一种添加了MPL的铝盐佐剂[8-9]:
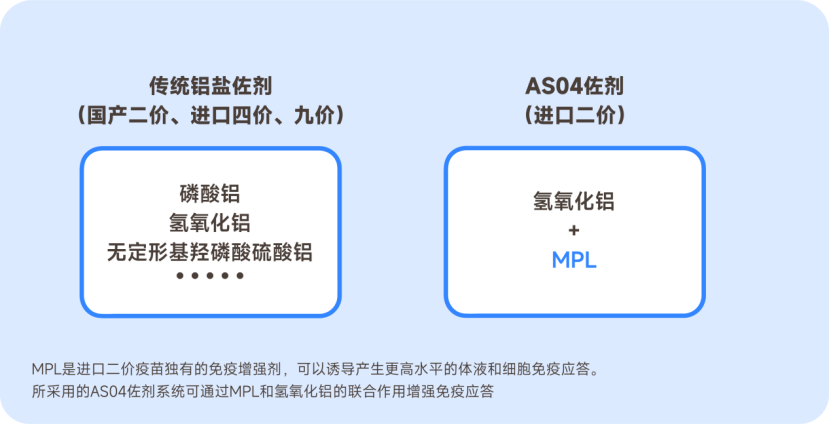
(约苗原创)
☞相比于传统铝盐佐剂,AS04佐剂系统可诱导更强的免疫应答:
一项研究显示,与采用传统氢氧化铝佐剂的疫苗相比,进口二价HPV疫苗(AS04佐剂:氢氧化铝+MPL)诱导的抗体水平更高,产生的HPV-16和HPV-18型特异记忆B细胞数量更多,有助于维持高效且持久的免疫应答[10]:
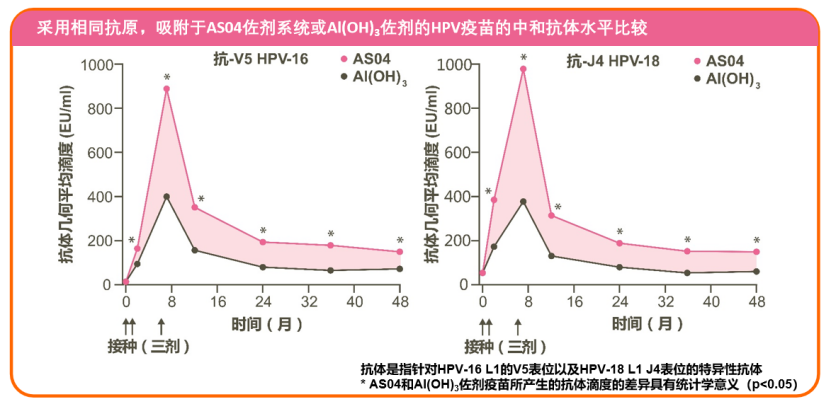
(一)HPV疫苗的有效性
HPV疫苗已被证实非常有效!
我们已经介绍了HPV疫苗的基本信息,那接下来看看HPV疫苗的“有效性”吧,毕竟这是大家重点关注的,如果疫苗无效的话,那岂不是白打了。那就从“保护效力”、“真实人群保护效果”两个方面来关注,具体如下↓
①HPV疫苗的保护效力:
HPV疫苗在预防HPV型别相关疾病的临床试验中显示出78.59%~100.0%的保护效力[3-7]。
以进口二价HPV疫苗为例:
Ø 一项针对18~25岁中国女性的临床研究随访72个月的结果显示:在除HPV16/18其他高危型HPV阳性的女性中,进口二价HPV疫苗预防HPV16/18相关12个月持续感染的保护效力为100%[11]。
Ø 进口二价HPV疫苗除了能预防HPV16/18型外,还可以对其他对高危型HPV 31/33/45提供交叉保护效力,对不论型别的CIN3+的保护效力高达93.2%[5]。
进口二价HPV疫苗对其它非疫苗高危型别的交叉保护效力[5]
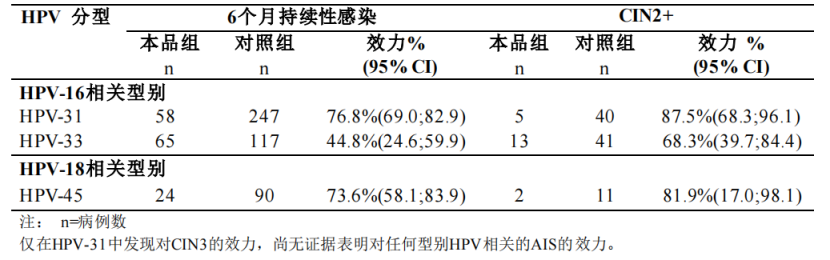
②HPV疫苗在真实人群中保护效果
以进口二价HPV疫苗为例:
Ø 英格兰真实世界研究表明,推行进口二价HPV疫苗免疫接种对减少宫颈癌的保护效果为87%,大幅度降低宫颈癌的发生[12]。
Ø 在苏格兰的真实世界中,接种进口二价HPV疫苗后,HPV16/18型感染降低了89.1%。另外日本真实研究中,针对亚裔人群,同样也降低了95.5%[13]。
(二)HPV疫苗的持续时间
接种HPV疫苗可提供长久保护!
相信很多人在打HPV疫苗前都会考虑一个问题“疫苗打完后能保护多久?”,即“HPV疫苗的免疫持续时间是多久?”,还有一部分人会直接问“疫苗打了后是终生有效吗?”
HPV疫苗是否终生有效还不能下定论。HPV疫苗在2006年第一次上市,至今上市十多年,由于没有足够的时间证明,目前还不得而知。所以HPV疫苗的免疫持续时间甚至终生有效也只有留给时间来回答。
不过可以给大家打剂强心针,顶级期刊柳叶刀发布一项来自哥斯达黎加的研究显示:进口二价HPV疫苗保护效果至少能持续11年![14]
哥斯达黎加疫苗试验于2004年6月28日-2005年12月21日期间纳入7446名18-25岁女性,其中3727人接种进口二价HPV疫苗,3739人接种对照疫苗。在2009年3月30日至2012年7月5日期间,HPV疫苗组的2635名妇女和新的未接种疫苗的对照组的2836名妇女参加了长期随访研究。接种进口二价HPV疫苗者在随访11年后:
Ø 预防HPV 16/18相关的CIN2+的有效性为100%;对预防CIN2+的累积有效性为97.4%。
Ø 和CIN2+的结果相似,预防HPV 16/18相关的CIN3+的有效性为100%,对预防CIN3+的累积有效性为94.9%。
这项随访研究证实了进口二价HPV疫苗可为女性提供长期保护,保护效果至少能持续11年!
(三)HPV疫苗的安全性
HPV疫苗接种后耐受性良好!
HPV 疫苗在上市前经历了严格的临床试验,保证有效性的同时,更重要的是确保其安全性。现有的5种疫苗上市临床试验表明具备良好的耐受性,但与其他疫苗类似,接种HPV疫苗可以引起接种部位或全身反应等不良事件(AE)。
国内一项研究数据:HPV 疫苗接种后不良反应发生率为55.56%,多数症状反应较轻微,仅0.40% 发生严重接种不良反应[15]。常见的接种部位局部反应包括疼痛、红斑和肿胀,全身反应主要有发热、头痛、眩晕、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛)等[14]。
进口二价HPV疫苗在人群中具有良好的耐受性[16-19]

由于我国目前HPV疫苗接种率较低,因此关于HPV疫苗接种后的真实世界数据也有限,目前靠一些临床试验数据来观察HPV疫苗的安全性。由于临床试验的持续时间相对较短以及抽样样本十分有限,可能有某些潜在的接种后不良事件无法及时监测到或者尚未表现出来。因此,我国对HPV疫苗上市后安全性的持续监测及相关数据的分析研究显得尤为重要[20]。
目前在我国已上市的5种HPV疫苗均有良好的保护效力,其中进口二价HPV疫苗在真实世界人群中已证实其对宫颈癌的保护效果,且耐受性良好。目前我国HPV疫苗覆盖率比较低,可早接种、早预防,早安心。
愿携手共进,以致力于没有人患宫颈癌的未来!
PM-CN-CER-NLTR-230041 有效期 2025.08
本资料并非广告。本资料基于科学信息制作且仅供医疗保健专业人士阅读。请勿传播本资料。
参考文献:
[1] 任俊红,等.医护专业实习生人瘤病毒及其疫苗相关认知的研究[J].现代医药卫生;2022;38(3):368-372.
[2] 中华医学会妇科肿瘤学分会.人瘤病毒疫苗临床应用中国专家共识[J].中国医学前沿杂志(电子版);2021;13(2):1-12.
[3] 二价HPV(国产)沃泽惠说明书-沃森
[4] 二价HPV疫苗(国产)馨可宁说明书-厦门万泰
[5] 二价HPV疫苗(进口)-希瑞适说明书-GSK
[6] 四价HPV疫苗(进口)-佳达修4说明书-默沙东
[7] 九价HPV疫苗(进口)-佳达修9说明书-默沙东
[8] 郭舒杨,等.新型佐剂疫苗药学研究的思考[J]. 中国新药杂志; 2020; 29(17): 1939-1943.
[9] 于永利. AS系列佐剂[J]. 微生物学免疫学进展;2017;45(1):1-6.
[10] Giannini SL,et al.Enhanced humoral and memory B cellular immunity using HPV16/18 L1 VLP vaccine formulated with the MPL/aluminium salt combination (AS04) compared to aluminium salt only. Vaccine. 2006 Aug 14;24(33-34)5937-49. PMID:16828940
[11] Hu SY,et al.Efficacy of the AS04-adjuvanted HPV-16/18 vaccine in young Chinese women with oncogenic HPV infection at baseline: post-hoc ysis of a randomized controlled trial.Hum Vaccin Immunother. 2021 Apr 3;17(4):955-964. PMID: 33180670
[12] Falcaro M,et al.The effects of the national HPV vaccination programme in England, UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. Lancet. 2021 Dec 4;398(10316):2084-2092. PMID:34741816
[13] 中华医学会妇科肿瘤学分会.子宫颈癌等人瘤病毒相关疾病免疫预防专家共识[J].中华预防医学杂志;2019;53(8):761-803.
[14] Porras C,et al.Efficacy of the bivalent HPV vaccine against HPV 16/18-associated precancer: long-term follow-up results from the Costa Rica Vaccine Trial.Lancet Oncol. 2020 Dec;21(12)1643-1652. PMID:33271093
[15] 陈晓敏,等.人瘤病毒疫苗接种不良反应的主动监测与全程接种率的提高对策[J].妇儿健康导刊.2023;2(4):51-53.
[16] Angelo MG,et al. Pooled ysis of large and long-term safety data from the human papillomavirus-16/18-AS04-adjuvanted vaccine clinical trial programme. Pharmacoepidemiol Drug Saf. 2014 May;23(5):466-79. PMID:24644063
[17] Romanowski B,et al.Immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine administered as a 2-dose schedule compared with the licensed 3-dose schedule: results from a randomized study. Hum Vaccin. 2011 Dec;7(12):1374-86. PMID:22048171
[18] Leung TF,et al.Comparative immunogenicity and safety of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine and HPV-6/11/16/18 vaccine administered according to 2- and 3-dose schedules in girls aged 9-14 years: Results to month 12 from a randomized trial. Hum Vaccin Immunother. 2015;11(7):1689-702. PMID:26062002
[19] Huang LM,et al.Sustained Immunogenicity of 2-dose Human Papillomavirus 16/18 AS04-adjuvanted Vaccine Schedules in Girls Aged 9–14 Years: A Randomized Trial. J Infect Dis. 2017 Jun 1;215(11)1711-1719. PMID:28591778
[20] 资文瑞,等.我国上市人瘤病毒疫苗接种及安全性研究[J]. 中国药物警戒.2023;20(3):311-316.
希瑞适®简明处方资料
【药品名称】
通用名:双价人瘤病毒吸附疫苗
商品名:希瑞适(CERVARIX)
【成份和性状】
活性成份:
1剂量( 0.5ml)含:
人瘤病毒 16型 L1蛋白 * 20μg
人瘤病毒 18型 L1蛋白 * 20μg
* L1蛋白,以非感染性的病毒样颗粒(VLPs)形式存在,通过 DNA重组技术用杆状病毒表达系统在源于粉纹夜蛾的 Hi-5 Rix4446细胞中表达而获得。
佐剂:
AS04佐剂系统 ,1剂量( 0.5ml)含 :
3-O-去酰基 -4’-单磷酰脂 A(MPL) 50μg
氢氧化铝 水合物 Al 3+ 总量 0.5mg
其它 辅料:
氯化钠、二水合磷酸氢钠、注射用水
性状:
0.5ml注射用悬液,装于玻璃预充注射器中。
本品静置时为无色上清液和白色沉淀 ,摇匀后呈混浊液 。
【接种对象】
本品适用于9~45岁的女性。
【作用与用途】
本品适用于预防因高危型人瘤病毒(HPV)16、18型所致下列疾病:
•宫颈癌
•2级、3级宫颈上皮内瘤样病变(CIN2/3)和原位腺癌(AIS)
•1级宫颈上皮内瘤样病变(CIN1)
【规格】
0.5ml/支(含HPV-16 L1蛋白和HPV-18 L1蛋白各20μg)。
【免疫程序和剂量】
(1)本品肌肉注射,首选接种部位为上臂三角肌。
(2)本品推荐于0、1和6月分别接种1剂次,共接种3剂,每剂0.5ml。
根据本品境外研究数据,第2剂可在第1剂后1~2.5个月之间接种,第3剂可在第1剂后5~12个月之间接种。
(3) 根据本品临床试验结果并参考2017年WHO《HPV疫苗立场文件》推荐,对于9~14岁女性也可以选择采用0、6月分别接种1剂次的免疫程序,每剂0.5ml。
尚未确定本品是否需要加强免疫。
【不良反应】
全身不良反应
十分常见:疲乏、头痛、肌痛、发热(境内数据,≥37 °C) 。常见:发热(境内数据,≥38 °C)、胃肠道症状(包括恶心、呕吐、腹泻和腹痛)、关节痛、瘙痒、皮疹和荨麻疹。偶见:上呼吸道感染、头晕。
局部不良反应
十分常见:注射部位疼痛、发红和肿胀。 偶见(境外临床试验):注射部位的其他反应,如硬结、局部感觉异常。
以上大部分不良反应程度为轻至中度,且短期内可自行缓解。
详细不良反应请参见希瑞适产品说明书。
境外上市后监测
除了上述临床试验中报告的不良反应以外,自本品上市后(2007年),从全球收集了以下不良事件报告(包括严重不良事件和可能与本品接种相关的事件)。由于这些事件来自自发报告的无法确定总数的人群,因此,无法准确地估计其发生频率或确定其与本品接种之间的因果关系。
免疫系统异常:
过敏反应(包括速发过敏反应和类速发过敏反应),血管性水肿,血小板减少性紫癜。
神经系统异常:
接种导致的晕厥或血管迷走神经反应(有时还伴有强直-阵挛性发作)。
急性播散性脑脊髓炎(ADEM):接种后数天至2周左右,有可能会出现发热、头痛、惊厥、运动障碍性疾病或意识障碍。具体频率不详。
格林巴利综合征:表现为诸如从肢体远端开始的弛缓性麻痹这类症状、腱反射下降或消失。具体频率不详。
血液及淋巴系统异常:淋巴结病
全身性异常:寒战
有报道在接种本品后,某些受种者可能会出现不局限于注射部位的剧痛(如肌肉痛、关节痛和皮肤痛)、麻木、无力感等并且持续较长时间,但发生机制尚未明确。因此,如果出现此类异常,应采取适当的措施,如前往能够进行神经学和免疫学鉴别诊断并提供专业诊疗的医疗机构就诊。
【禁忌】
对本品中任一活性成分或辅料严重过敏者。
【注意事项】
1. 接种本品前医疗人员应询问和审阅受种者的病史(尤其是既往接种史和是否发生过与疫苗接种有关的不良反应)并进行临床检查,评估接种本品的获益与风险。本品不推荐用于该说明书【接种对象】以外人群。
2. 与其他注射用疫苗一样,需准备适当的医疗应急处理措施和监测手段,以保证在接种本品后发生过敏反应者能够及时得到处置。
3. 晕厥反应:接种疫苗后可能会出现晕厥,导致跌倒并受伤,因此,建议接种后留观至少15分钟或按接种要求留观。
4. 乳胶反应:本品预充式注射器的针帽可能含有天然胶乳,会引起乳胶敏感人群的过敏反应。
5. 与其他疫苗一样,在受种者患有急性严重发热疾病时应推迟接种本品。如果仅为感冒等轻微感染,则无需推迟接种。
6. 本品严禁静脉或皮内注射。尚无本品皮下接种的临床数据。受种者为血小板减少症患者或者任何凝血功能紊乱患者时应谨慎使用本品。
7. 与其他疫苗一样,接种本品可能无法对所有受种者产生100%的保护作用。
8. 本品仅用于预防用途。
9. 本品不能预防所有高危型HPV感染所致病变。
10. 疫苗接种不能取代常规宫颈癌筛查,也不能取代预防HPV感染和性传播疾病的其他措施。
11. 受限于相关临床数据的佐证,当无症状的HIV感染者或免疫功能低下者接种本品时,可能无法产生足够的免疫应答。
12. 目前尚未无安全确定本品的保护时长。
详细注意事项请参见希瑞适产品说明书
【妊娠和哺乳期妇女用药】
在妊娠妇女中收集到的有限数据尚不足以判断接种本品后是否导致发生不良妊娠的风险。妊娠期间应避免接种本品。若女性已经或准备妊娠,建议推迟或中断接种程序,妊娠期结束后再进行接种。
在临床试验中,尚未观察本品诱导的抗体经母乳分泌情况。由于许多药物可经母乳分泌,因此,哺乳期妇女接种本品时应谨慎。
【药物相互作用】
由于境内尚未进行本品与其他疫苗联合接种的临床试验,目前暂不推荐本品与其它疫苗同时接种。接种本品前三个月内避免使用免疫球蛋白或血液制品。
由于缺乏配伍禁忌研究,因此本品禁止与其他医药产品混合注射。
【贮藏】
冷藏储存于2°C~8°C,避光保存于原包装盒内。不得冻结,如发生冻结应予以废弃。贮藏期间,可能会观察到疫苗中存在白色细小沉淀和无色澄清上清液,这并不代表疫苗变质。
【有效期】 48个月。
【执行标准】 进口药品注册标准:JS20120047。
【批准文号】 药品批准文号:国药准字SJ20160025。
【生产企业】
企业名称:GlaxoithKline Biologicals S.A.
生产地址:Parc de la Noire Epine, Rue Fleming 20, Wavre 1300, Belgium
驻中国办事处:上海市中路168号都市总部大楼6楼; 邮编:200001
电 话:86 21-23019800
传 真:86 21-23019801
GSK服务热线:800-820-3383/400-183-3383
本网信息来自于互联网,目的在于传递更多信息,并不代表本网赞同其观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,并请自行核实相关内容。本站不承担此类作品侵权行为的直接责任及连带责任。如若本网有任何内容侵犯您的权益,请及时联系我们,本站将会在24小时内处理完毕,E-mail:xinmeigg88@163.com
本文链接:http://zy.tttmy.cn/news/1216.html